Dix ans de rapports sur la fibrose systémique néphrogénique (FSN) – Quelles conclusions peut-on tirer des résultats de l’étude? – Cliquez ici pour voir la vidéo (en anglais)
L’Agence européenne des médicaments (EMA)1 et la Société européenne de radiologie urogénitale (ESUR)2 classent tous les produits de contraste à base de gadolinium (PCBG) macrocycliques comme des produits présentant un faible risque d’entraîner une FSN. L’Association canadienne des radiologistes (CAR)3 et l’American College of Radiology (ACR)4 ont tiré une conclusion semblable. La classification du risque de FSN est en grande partie fondée sur les rapports de cas de FSN associés à l’administration d’un agent unique. Cependant, différents nombres de rapports de cas de FSN sont fréquemment cités.
Dans une étude récente, Endrikat et coll.5 ont analysé 779 rapports de cas de FSN reçus par Bayer à l’échelle mondiale entre 2006 et 2016. L’analyse a montré que l’année d’introduction sur le marché et la part de marché entre 1996 et 2007 ont eu une forte influence sur le nombre absolu de cas de FSN signalés pour les PCBG linéaires et macrocycliques. Par conséquent, la probabilité a priori de trouver des cas de FSN associés à un agent unique diffère grandement, même pour des PBCG de la même classe.
La plupart des cas de FSN associés à un agent unique ont été signalés aux É.-U. Jusqu’en 2006, la part de marché combinée des PCBG linéaires Magnevist® et OmniscanMC, les deux PCBG associés au plus grand nombre de cas de FSN signalés, dépassait 80 %. Tous les autres PCBG approuvés avaient une part de marché plus faible ou avaient été commercialisés aux É.-U. après mai 2007, moment où les recommandations de la FDA relatives à l’innocuité sont entrées en vigueur (Figure 1).
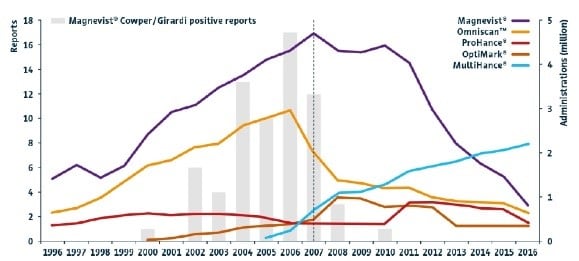
Figure 1. Administrations annuelles de PCBG aux É.-U. (lignes, axe des ordonnées de droite) et rapports de cas de FSN confirmés associés à Magnevist® aux É.-U. (positifs selon les critères Cowper/Girardi et liés à un agent unique, n = 68) (colonnes, axe des ordonnées de gauche). La ligne pointillée verticale indique l’introduction de la mise en garde encadrée par la FDA en mai 2007, après quoi le nombre de rapports a considérablement diminué. Jusqu’en 2006, Magnevist® et OmniscanMC détenaient plus de 80 % de la part de marché combinée. Primovist®, Gadovist® et Dotarem® n’ont respectivement fait leur entrée sur le marché américain qu’en 2008, 2011 et 2013.
Finalement, l’interprétation des rapports de cas de FSN n’est pas normalisée, ce qui peut entraîner une grande variabilité dans la classification des causes.
Les auteurs concluent que le simple fait de se fier au nombre de cas signalés, plus particulièrement pour les cas associés à un agent unique, n’est pas scientifiquement valable et peut être trompeur lorsqu’on utilise les chiffres pour différencier les produits. En outre, une évaluation comparative des risques associés à différents PCBG devrait tenir compte de paramètres plus objectifs, comme la stabilité, la pharmacocinétique et la dose.
Documentation
1 European Medicines Agency: Assessment report for Gadolinium-containing contrast agents. July 2010
2 ESUR Contrast Media Safety Commitee of the European Society of Urogenital Radiology: ESUR Guidelines on Contrast Media (version 10.0). Vienna (Austria): ESUR Head Office; 2018. Consulté en mars 2018.
3 Canadian Association of Radiology: Gadolinium-Based Contrast Agents in Kidney Disease. Consulté en mars 2018.
4 ACR Committee on Drugs and Contrast Media: ACR Manual on Contrast Media. Version 10.3, 2018
5 Endrikat J, Dohanish S, Schleyer N, et al. 10 Years of Nephrogenic Systemic Fibrosis: A Comprehensive Analysis of Nephrogenic Systemic Fibrosis Reports Received by a Pharmaceutical Company from 2006 to 2016. Invest Radiol. 2018;53(9):541–550. Les auteurs de l’étude sont des employés de Bayer.
PP-PF-RAD-CA-0031-1

